 |
Biopolímeros (4831) |
 |
|
Módulo 2. Ficha
2.1
|
 |
Biopolímeros (4831) |
 |
|
Módulo 2. Ficha
2.1
|
FUERZAS QUE DETERMINAN LA ESTRUCTURA MACROMOLECULAR
2.1. Introducción
Cuando dos o más átomos estan juntos formando una molécula las fuerzas que los unen fuertemente se llaman fuerzas covalentes y a las distancias interatómicas (entre sus núcleos) se les llama distancia de enlace covalente. El enlace metálico es de la misma naturaleza que los enlaces covalentes sencillos. Ambas clases de enlaces se caracterizan porque los electrones están compartidos por dos o más átomos de manera que la naturaleza discreta de los átomos se pierde.
La posición que un átomo o elemento ocupa en la tabla periódica condiciona el número de enlaces covalentes que puede formar con otros átomos. Este número o estequiometría se conoce como valencia atómica; por ejemplo, es cero para los gases nobles -los cuales no pueden normalmente formar enlace con otros átomos- uno para el hidrógeno, dos para el oxígeno, tres para el nitrógeno, cuatro para el carbono, etc. Una característica del enlace covalente es su direccionalidad, es decir, los enlaces están dirigidos u orientados entre ellos con ángulos bien definidos. De aquí que, en átomos multivalentes, los enlaces covalentes determinan la forma en la que se coordinarán entre ellos en la molécula o en los sólidos cristalinos para formar un red ordenada tridimensional. Por ejemplo, la manera en la que los átomos de carbono se distribuyen para formar la red tridimensional perfectamente ordenada de la estructura del diamante. Las fuerzas covalentes son muy fuertes y de corto alcance, es decir operan a distancias muy cortas, del orden de las separaciones interatómicas (0'1-0'2 nm).
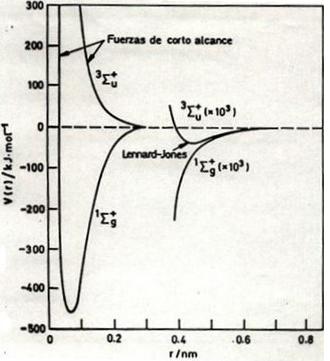 |
| Energía electrónica de la molécula de hidrógeno en su estado fundamental (mímimo, distancia de enlace 0,08 nm aproximadamente) y en su primer estado excitado. A la derecha a distancias mucho mayores aparece superpuesta la curva de potencial intermolecular (en una escala 1000 veces mayor) de dos átomos de hidrógeno que darán lugar a los estados enlazantes y antienlazantes moleculares a distancias menores. Observe que el mínimo del potencial intermolecular aparece alrededor de 0,42 nm (distancia de Van der Waals) |
|
Energía
de enlace de algunos enlaces covalentes
|
|||
|
Tipo
de enlace
|
Energía
(kJ/mol)
|
Tipo
de enlace
|
Energía
(kJ/mol)
|
|
C=O
(HCHO)
|
690
|
C
- C (C2H6)
|
360
|
|
C=C
(C2H4)
|
600
|
C
- O (CH3OH)
|
340
|
|
C
- H (CH4)
|
430
|
N
- O (NH2OH)
|
200
|
A las fuerzas entre átomos discretos y moléculas no enlazados, fuerzas intermoleculares, se las llama normalmente fuerzas físicas y dan lugar a los enlaces físicos, en contraste con las fuerzas químicas que dan lugar a los enlaces químicos o covalentes. En las reacciones químicas se rompen y se forman enlaces covalentes dando lugar a la formación de nuevas moléculas.
Los enlaces físicos normalmente no son específicos, y no tienen la estequiometría y fuerte direccionalidad de los enlaces químicos. Son las fuerzas que mantienen a las moléculas unidas en los líquidos, puesto que las moléculas se pueden mover y rotar a la vez que permanecen "unidas" unas a las otras. Estrictamente los "enlaces físicos" no se consideran enlaces en absoluto, debido a que en la unión covalente la distribución de carga electrónica de los átomos unitarios cambia totalmente y los electrones son efectivamente compartidos entre dos o varios núcleos, mientras que en el enlace físico esta distribución de carga se ve simplemente perturbada, los átomos permanecen como entidades distintas. A pesar de ello, las fuerzas físicas pueden llegar a ser tan fuertes como las covalentes, e incluso las más débiles son lo suficientemente fuertes para mantener unidos a los átomos de los gases nobles en estado líquido, o a las moléculas unidas en los sistemas coloidales y asociaciones biomoleculares. Por estos motivos además de por su naturaleza de largo alcance, las fuerzas físicas son las fuerzas reguladoras de todos los fenómenos que no implican reacción química.
 Ficha
Siquiente Ficha
Siquiente |