 |
Biopolímeros (4831) |
 |
|
Módulo 3. Ficha
3.3.1
|
 |
Biopolímeros (4831) |
 |
|
Módulo 3. Ficha
3.3.1
|
PROTEÍNAS
3.3.Propiedades químico-físicas de los monómeros
3.3.1 Ionización de aminoácidos y péptidos
En disolución acuosa, el pKa de un ácido carboxílico alifático como el ácido acético es 4,16 y el pKa de una amina también alifática como la hidroxilamina es 10,59. En un a-aminoácido, en donde el grupo amino y el grupo carboxílico son sustituyentes del mismo carbono a, el campo eléctrico de cada uno de los iones que se forman está altamente influenciado, de forma que ambos pKa se desplazan hacia la zona ácida. En el apartado 3.2 se dan los valores de estas constantes de ionización que varían ligeramente de unos aminoácidos a otros pero que, en general, están en torno a 2,3 para el grupo carboxílico y 9,8 para el grupo amino. Además la molécula formada a pH neutro tiene carácter zwitteriónico, por lo que la interacción electrostática entre ambas cargas dificulta por una parte la salida del protón del grupo NH 3+ en la zona básica, así como la entrada del protón en el carboxilato en la zona ácida. A medida que los grupos amino y carboxilato están más alejados entre ellos por la sucesiva entrada de monómeros al formar el polipéptido, su influencia electrostática mutua va disminuyendo, de suerte que para un grado de polimerización cuatro o cinco, el efecto realmente importante en la ionización de estos grupos es su proximidad al enlace amida del polipéptido formado y no el efecto de campo electrostático mutuo del catión y el anión. Obsérvese en el cuadro siguiente cómo varian los pKa de homopolipéptidos de alanina.
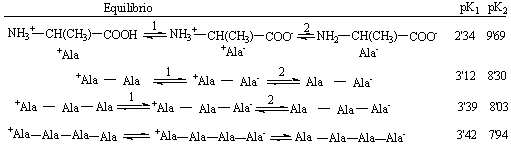
El razonamiento anterior puede aplicarse al equilibrio de ionización de dímeros Ala-Lys con valores de pKa de 3,22, 7,62 y 10,70 que deben asignarse claramente a la ionización del carboxilato, el amino peptídico y el amino de la cadena lateral de la lisina (el pKa de la hexilamina es 10,59). En el tetrámero Ala-Ala-Lys-Ala los valores de pKa encontrados son 3,58; 8,01 y 10,.58 ¿Son razonables estos valores? Sin embargo para un trímero Lys-Lys-Lys los valores de pKa experimentales encontrados son: 3,06; 7,34; 9,80, 10,54 y 11,32 lo que indica claras influencias mutuas de las cadenas laterales. Muchas veces estas influencias mutuas resultan difíciles de interpretar. En proteínas, a veces se encuentran grupos funcionales con pKas muy alterados (vease tabla siguiente), lo cual debe depender del entorno local concreto.

Ficha
anterior 
|
 Ficha
Siquiente Ficha
Siquiente |