 |
Biopolímeros (4831) |
 |
|
Módulo 3. Ficha
3.5.3
|
 |
Biopolímeros (4831) |
 |
|
Módulo 3. Ficha
3.5.3
|
PROTEÍNAS
3.5. Estructura de las proteína
3.5.3. Estructura secundaria
La estructura secundaria de cualquier región en una proteína está definida por la conformación de la cadena principal (esqueleto) polipeptídica en esa región. Esta conformación está definida por la situación espacial del conjunto de los tres átomos (el cuarto, el H está condicionado por la disposición de los otros tres) que forman la cadena, es decir, el carbono a (Ca), el carbono carbonílico (C') y el nitrógeno amídico N). Sus posiciones y por tanto la estructura secundaria , puede ser definida por el valor de los ángulos de rotación alrededor de los enlaces que conectan estos tres átomos: f, y y w. La figura muestra un segmento de la cadena con un resíduo i,seguido de un resíduo i+1 y precedido de un resíduo i-1 en una configuración totalmente extendida.
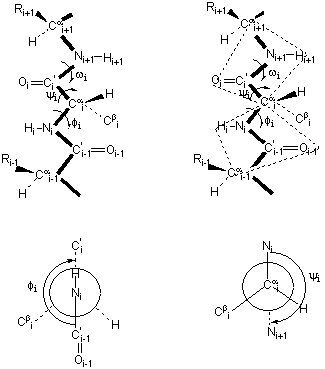
.Definición de los ángulos de torsión (diedros de rotación) f, y y w . Los dibujos de la parte inferior de la figura son las proyecciones de Newman del ángulo f, a lo largo del enlace Ni- Ca i(izquierda) y del ángulo y a lo largo del enlace Cai - Ci(derecha)
El ángulo de torsión w define la rotación alrededor del enlace peptídico C'i- Ni+1. Mide la rotación del plano que contiene a N i+1, Ca i+1 y H i+1 respecto del plano que contiene Ca i , C'i, y O i ( y N i+1). El ángulo w toma el valor de 0º cuando Ca i+1 están en el mismo plano que Ca i, C' i y O i y Ca i+1 y Ca i están en cis. Los valores de w son positivos cuando mirando el enlace C'i- Ni+1 desde el átomo C'i la dirección de la rotación es en el sentido de las agujas del reloj. Cuando Ca i+1 y Ca i están en trans el valor de w es de 180º. Como ya se dijo anteriormente, en polipéptidos este ángulo es prácticamente constante e igual a 180º, por lo que la estructura secundaria de la cadena viene, de hecho, definida por la rotación de las unidades peptídicas planares alrededor de los enlaces que las conectan al carbono a.
El ángulo de torsión f define la rotación del plano que contiene a contiene Ca i , C'i, y O i ( y N i+1) alrededor del enlace Ni- Cai, y se mide a partir del plano en que se encuentran Ca i, Ni, y C' i-1 . Puesto que el enlace peptídico es plano, Oi-1 y Ca i-1 están también en este plano. El ángulo es 0º cuando C'i está en el mismo plano que Cai, Ni y C' i-1 y C' i y C' i-1 están en cis (sin). Los valores de f son positivos cuando mirando el enlace Ni- Cai desde el átomo Ni la dirección de la rotación es en el sentido de las agujas del reloj. En la figura C' i y C' i+1 están en trans (anti) el valor de f es de 180º.
El ángulo y define la rotación del plano que contiene a contiene C'i , O i y N i+1 alrededor del enlace Cai - Ci, y se mide a partir del plano en que se encuentran C' i , Ca i, y Ni, (y C' i-1) . Puesto que el enlace peptídico es plano, Oi-1 y Ca i-1 están también en este plano. El ángulo es 0º cuando N i+1 está en el mismo plano que C' i, Cai, Ni y N i y Ni+1 están en cis. Los valores de y son positivos cuando mirando el enlace Cai - Ni desde el átomo Cai la dirección de la rotación es en el sentido de las agujas del reloj. En la figura N i y N i+1 están en trans (anti) y el valor de f es de 180º. (180º=-180º).
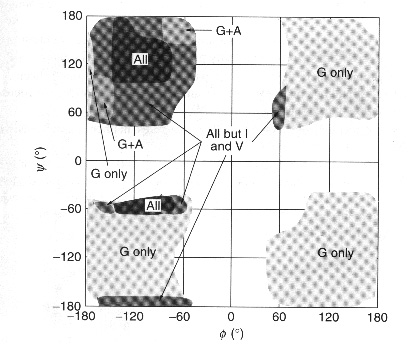
Los impedimentos estéricos hacen que determinadas parejas de valores de estos ángulos sean totalmente imposibles de alcanzar en las conformaciones polipeptídicas. Incluso en el caso de la poliglicina (pGly) en donde el tamaño de la cadena lateral es el más pequeño de todos los aminoácidos, no es posible tener conformaciones del polímero en que todos los valores de f y y sean compatibles. Las conformaciones espaciales que son accesibles pueden representación en un diagrama bidimensional. A este tipo de representaciones se les llama diagramas de Ramachandran como los que se muestran en las figuras siguientes, en donde la primera es un diagrama de Ramachandran en el que muestran las regiones restringidas a los diferentes aminoácidos y la segunda es otro diagrama de Ramachandran en donde se señalan las conformaciones preferidas en las cadenas protéicas.
 |
|
|
Diagrama de Ramachandran
que muestra las diferentes restricciones
conformacionales de los aminoácidos. Las zonas sombreadas son
las zonas permitidas. Notese la gran libertad conformacional de la
glicina y las restricciones que aparecen en la isoleucina (I) y valina
(V)
|
Diagrama
de Ramachandran que muestra
las conformaciones preferidas en las cadenas polipeptídicas.
|
Los diagramas de Ramachandran sólo indican las conformaciones que están permitidas o prohibidas por interacciones estéricas. La inclusión en la función de potencial interatómico de funciones de interacciones dipolares (recuerdese la gran polaridad del enlace peptídico) reduce aún más el número de conformaciones accesibles en las cadenas polipeptídicas. Entre todas estas conformaciones permitidas hay algunas que están clarísimamente estabilizadas cuando se tienen en cuenta la posibilidad de formación de enlaces de hidrógeno entre las unidades peptídicas de la cadena (NH...O). Estas conformaciones son principalmente la hélice a (a helix) y la hoja (b sheet)
Ficha
anterior 
|
A
Docencia  |