 |
Biopolímeros (4831) |
 |
|
Módulo 3. Ficha
3.5.3.3
|
 |
Biopolímeros (4831) |
 |
|
Módulo 3. Ficha
3.5.3.3
|
PROTEÍNAS
3.5. Estructura de las proteína
3.5.3.4 Poliprolina y colágeno
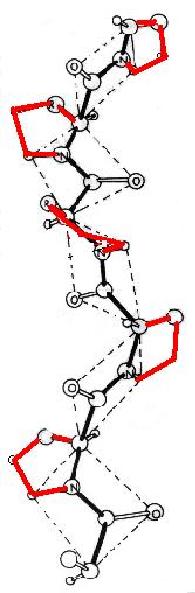 |
Anteriormente se ha mencionado que la prolina es un aminoácido especial ya que la presencia del anillo de cinco miembros de la cadena lateral impide la libre rotación alrededor del enlace f y este queda fijado aproximadamente en -65º. Ya se ha mencionado también que el impedimento estérico alrededor de su anillo limita muchísimo las posibilidades conformacionales del residuo localizado en el extremo animo terminal de la prolina, de forma que la conformación del resíduo X en una secuencia X-Pro es bastante improbable que sea hélice a. Además la carencia del átomo de H unido al nitrógeno impide la formación de puentes de hidrógeno dificultando la formación de hélice a. Sin embargo la prolina, en forma de poliprolina, puede formar dos estructuras helicoidales absolutamente únicas en el sentido de que no contienen enlaces de hidrógeno. La poliprolina I es un hélice levógira que tiene 10 resíduos por vuelta y tiene todos los enlaces peptídicos en configuración cis y la poliprolina II que también es levógira, pero en donde los enlaces peptídicos están en configuración tras. En disolventes acuosos la poliprolina II es la más estable, tiene 3 resíduos por vuelta y un desplazamiento a lo largo del eje de la hélice de 3'12 A. En la figura de la izquierda se muestra esta poliprolina II en la que no existen puentes de hidrógeno y la hélice está estabilizada principalmente por interacciones estéricas. Con la excepción del colágeno, no es normal encontrar en la naturaleza proteínas que tengan varias prolinas consecutivas y por tanto que presenten estructuras secundarias como la que se acaba de describir.
Conformación de una sola hebra componente de la triple hélice del colágeno. La secuencia que se representa es Gly-Pro-Pro-Gly-Pro-Pro |
El colágeno, la proteína más abundante en los mamíferos, es una proteína fibrosa, componente principal de la piel, huesos, tendones, cartílago y dientes y que es una molécula con forma de varilla rígida de unos 3000 A de longitud y 1'5 A de diámetro. El colágeno tienen una composición absolutamente inusual en la que dominan la prolina, la glicina y la hidroxiprolina. El tropocolágeno está formado por tres tipos de cadenas polipeptídicas de aproximadamente 95.000 Dalton de peso molecular, dos de ellas absolutamente idénticas y una tercera bastante parecida que forman entre ellas una triple hélice. Todas ellas tienen una glicina cada dos posiciones en la secuencia y uno (o los dos) de los residuos entre las glicinas es prolina o hidroxiprolina (obsérvese la figura anterior y el model interactivo de más abajo). Las tres hebras (con las prolinas en configuración de poliprolina II) se enrollan entre si formando un cable superhelicoidal (Modelo interactivo siguiente). La unión entre las tres hebras se hace a través de enlaces de hidrógeno en los que los grupos dadores son los NH peptídicos de la glicina y los aceptores los CO peptídicos de las otras hebras. Los grupos hidroxilo de los resíduos hidroxiprolina también forman enlaces de hidrógeno. El interior del cable es muy compacto, de hecho el único resíduo que puede encajar en la posición interior el la glicina y los anillos de pirrolidona de la prolina quedan hacia fuera de la hélice.
|
Hélice triple del tropocolágeno Hélice sencilla de poliprolina II Empaquetamiento de las tres cadenas en Spacefill Empaquetamiento de las tres cadenas. Esqueleto y cadenas laterales
|
Ficha
anterior 
|
A
Docencia  |