 |
Biopolímeros (4831) |
 |
|
Módulo 2. Ficha
2.7
|
 |
Biopolímeros (4831) |
 |
|
Módulo 2. Ficha
2.7
|
FUERZAS QUE DETERMINAN LA ESTRUCTURA MACROMOLECULAR
2.7.El agua
|
|
El agua (H2O)es una pequeña molécula con forma de V. Pertenece al grupo puntual de simetría C2v; tiene un eje de simetría binario que pasa por el átomo de oxígeno y está contenido en el plano molecular. También tiene un plano de simetría que contiene al eje C2 y es perpendicular al plano molecular. En estado líquido, a pesar de que el 80% de los electrones moleculares están implicados en el enlace, los tres átomos no permanecen estáticos, sino que se están continuamente intercambiando entre ellos en un proceso de protonación/desprotonación que es catalizado tanto por ácidos como por bases. Incluso a pH 7, el tiempo de residencia del protón en una molécula de agua es del orden de milisegundos, a pesar de lo cual, la molécula de agua se considera una estructura permanente en la mayoría de las reacciones en las que toma parte, ya que estos suceden a una escala de tiempo mucho menor. |
Al describir el enlace en la molécula de agua, lo más habitual es considerar una hibridatión tetragonal sp3 de los electrones del átomo de oxígeno, dos de estos híbridos forman enlace sigma con los átomos de hidrogeno y los otros dos permanecen como pares de electrones solitarios. En una disposición tetraédrica perfecta el ángulo sería de 109,47 º. La disposición tetraédrica perfecta se ha encontrado en alguna de las fases condensadas del agua, como el hielo hexagonal. Sin embargo, los cálculos ab-initio de moléculas aisladas no confirman la presencia de densidad electrónica dirigida en el sitio donde se espera que esten los pares solitarios. Para moléculas aisladas, estos cálculos más bien parecen indicar la formación de una estructura con hibridación sp2 y un orbital p. Posiblemente esto podría explicar la formación enlaces de hidrogeno en disposición trigonal (casi planar) que se ha encontrado en la hidratación de sitios muy restringidos de proteínas donde el número de enlaces de hidrógeno dadores y aceptores no es el mismo.
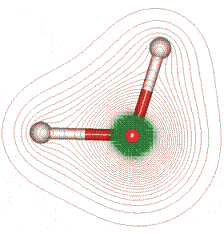 a a |
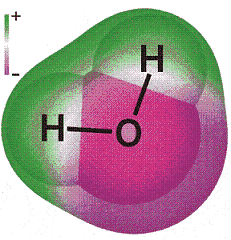 b b |
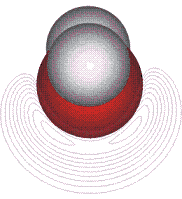 c c |
El la figura anterior se muestran algunas de las características de la molécula de agua, determinadas con metodología ab-initio, utilizando el programa de cálculo HyperChem. (a) Distribución de densidad electrónica en la molécula de agua. Obsérvese como la densidad es mucho mayor alrededor del átomo de oxígeno, así que la polarizabilidad mayor de la molécula está centrada en el átomo de oxígeno (1.4146 ┼3) y sólo una pequeña polarizabilidad (0.0836 ┼3) está centrada sobre los átomos de H. Para una molécula aislada de agua ( H216O, H217O or H218O), la longitud de enlace O-H calculada con metodología ab-initio es 0.957854 ┼ y valor calculado para el ángulo H-O-H es104.500░. (b) Distribución de carga. Se observa que ésta depende fuertemente de la geometría atómica y puede estimarse que -0,7e de la carga, está situada sobre el átomo de oxígeno y que +0,7e está repartida igualmente entre los átomos de H.(c) Potencial electrostático. Aunque no se encuentran las densidades electrónicas direccionales en las posiciones que deberían adoptar los pares solitarios, sin embargo sí se encuentran mínimos de potencial electrostático en las posiciones esperadas.
Los valores experimentales de los parámetros estructurales de la molécula de agua gaseosa son 0.95718 ┼ para la distancia de enlace y 104.474░ para el ángulo. Estos parámetros no son en absoluto los que se obtienen en agua líquida. Los experimentos de difracción de neutrones aportan unos valores de 0.970 ┼ y 106░ para la distancia de enlace y el ángulo de enlace, respectivamente. Estos valores probablemente cambiarán dependiendo del entorno concreto de las moléculas de agua. Normalmente los modelos utilizan unas longitudes de enlace O-H que oscilan entre 0.957 ┼ y 1.00 ┼ y ángulos de enlace H-O-H con valores entre 104.52░ y 109.5░.
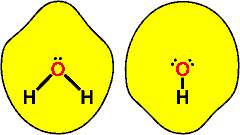
| El diámetro de Van der Waals de la molécula de agua se ha estimado en 2,82 ┼ (F. Franks, Water: 2nd Edition A matrix of life, Royal Society of Chemistry, Cambridge, 2000), aunque algunos datos experimentales indican que podría se algo mayor. Claramente, la molécula no es esférica con una variación en torno a un 5% en el diámetro de Van der Waals, dependiendo del eje elegido. Estas ligeras muescas están situadas en posiciones tetraédricas, aparentemente opuestas a las que deben ocupar los pares solitarios (véase el esquema) |
 |
Se han desarrollado modelos, más o menos complejos de la molécula de agua para poder predecir las propiedades físicas de la molécula de agua. Hasta el momento no tenemos el modelo adecuado que permita calcular todas las pecualiaridades del comportamiento químico-físico del agua. Las predicciones son muy dependientes de los parámetros usados por el modelo y a pesar de que algunos de ellos son bastante complejos, no pueden utilizarse para realizar predicciones en condiciones ambientales muy diferentes de aquellas para las que se han tomado los parámetros.
Una de las características más importantes de la molécula de agua es su gran tendencia a formar enlaces de hidrógeno intermoleculares.En el agua, el átomo de hidrogéno está unido covalentemente a un átomo de oxígeno con una energía de enlace de aproximadamente 492 kJ/ml. Adicionalmente este hidrógeno, tiene una atracción de unos 23,3 kJ/mol con un átomo de oxígeno de otra molécula vecina, la cual es bastante mayor que la interacción de van der Waals (5,5 kJ/mol). Estos enlaces de hidrógeno, como se ha establecido anteriormente tienen un 90% de naturaleza electrostática y un 10% de naturaleza cuántica.
En el agua, igual que en otros sistemas formadores de enlaces de hidrógeno, la fortaleza del enlace depende de su orientación y posición respecto de los otros átomos enlazados y no enlazados y de los "pares solitarios". Cuanto mayor sea la fortaleza del enlace H....O, menor será la fortaleza del enlace covalente O-H y menor será la distancia O....O. El principal criterio para determinar la fortaleza de los enlaces de hidrógeno son sus distancias intermoleculares y las frecuencias de sus modos de vibración de tensión y las de los enlaces covalentes de los hidrógenos dadores. Cualquier factor, por ejemplo la polarización, que reduzca la longitud de un enlace de hidrógeno, se espera que aumente su covalencia.
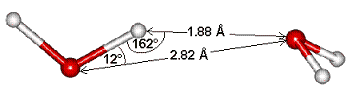 |
 |
|
Aunque
en los enlaces de hidrógeno de las moléculas de agua,
suele representarse a los átomos de hidrógeno dentro
de las líneas rectas que conectan los átomos de oxígeno,
lo cierto es que esto es bastante improbable que ocurra, incluso en
en hielo. En las figuras se reflejan los valores determinados por
estudios de apantallamiento magnético de protón.
|
Cuando entre dos moléculas se forma un enlace de hidrógeno, la redestribución electrónica que se produce, cambia las capacidades para formar posteriores enlaces de hidrógeno. La molécula que da el hidrógeno, aumenta la densidad electrónica en la región de los "pares solitarios", lo cual favorece la capacidad para aceptar hidrógeno; la molécula que acepta el hidrógeno, reduce la densidad electrónica centrada en sus átomos de hidrógeno y en su región de pares solitarios, lo cual favorece una ulterior donación de hidrógenos, pero dificulta la aceptación de hidrógenos. Esta redestribución electrónica en ambas moléculas tiene como resultado un fenómeno de cooperatividad y anticooperatividad en la formación de redes de enlaces de hidrógeno en el agua. Es decir, aceptar un hidrógeno favorece la donación de otro y aceptar un hidrógeno desfavorece la aceptación de otro.
El hielo es una red de enlaces de hidrógeno similar a la que se muestra en el esquema de la figura siguiente y da lugar a la formación de anillos de moléculas de agua, cada uno de los cuales contiene seis átomos de oxígeno y seis átomos de hidrógeno (resaltados en amarillo en la figura). En este modelo
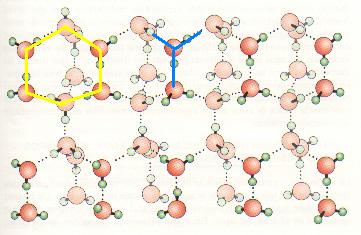 |
| Distribución tridimensional de las moléculas de agua en fase sólida en la que cada molécula forma cuatro enlaces de hidrógeno, dos dadores y dos aceptores en una configuración tetraédrica |
Los enlaces covalentes O-H alternan con los enlaces de hidrógeno O....H de cada anillo. Todos los ángulos de enlace para los oxígenos son aproximadamente tetraédricos, 109,5º, por lo que los anillos están fruncidos. Dos estructuras de anillo se unen formando tres enlades de hidrógeno (en azul). Esta estructura de tipo jaula se extiende en las tres dimensiones del espacio, como puede apreciarse en la figura anterior.La simetría de los anillos de seis eslabones queda reflejada en la simetría de orden seis de los copos de nieve.
Cuando, al haber acumulado suficiente energía térmica, el hielo es capaz de romper alguno de estos enlaces de hidrógeno y funde (0 ºC), su estructura abierta comienza a colapsar. Las moléculas se mueven y empiezan a ocupar parte del espacio vacío, dando lugar a un líquido más denso que el sólido. Cuando la temperatura aumenta ligeramente, el aumento de los choques entre ellas les permite encontrar más espacios vacíos que pueden ocupar, lo cual sigue aumentando su densidad. Este efecto de aumento de densidad alcanza su máximo a 3,98 ºC a la presión atmosférica. Cuando se aumenta la temperatura por encima de los 4 ºC, el aumento de la energía cinética (movimiento más rápido) aumenta ya la distancia entre ellas y el agua comienza un comportamiento similar al del resto de los líquidos de disminución de la densidad cuando aumenta la temperatura. En resumen en el agua líquida la tendencia a retener la red tetraédrica del hielo permanece, pero ahora con una estructura más lábil y desordenada. El número promedio de vecinos por molécula sube ahora a cinco (de aquí su mayor densidad), pero el número de enlaces de hidrógeno por molécula cae a 3'5 cuyo tiempo de vida media estimada es de alrededor de 10-11s.
Tutorial interactivo con la visualización de la estructura del agua. Eric Martz
Pßgina sobre la molÚcula de agua en la Universidad de London South Bank
Science, (1997) 276, 658.
Ficha
anterior 
|
 Ficha
Siquiente Ficha
Siquiente |