 |
Biopolímeros (4831) |
 |
|
Módulo 3. Ficha
3.5.3.3
|
 |
Biopolímeros (4831) |
 |
|
Módulo 3. Ficha
3.5.3.3
|
PROTEÍNAS
3.5. Estructura de las proteína
3.5.3.4 Tendencia de los aminoácidos a formar estructuras secundarias
La siguiente tabla (T.E. Creighton, Proteins: Structures and Molecular Properties) refleja la tendencia que tienen los diferentes aminoácidos a formar las diferentes estructuras secundarias presentadas anteriormente.
| Aminoácido | Hélice a | Hoja b |
Giro
b
|
|
Ala
|
1'29
|
0'90
|
0'78
|
|
Cys
|
1'11
|
0'74
|
0'80
|
|
Leu
|
1'30
|
1'02
|
0'59
|
|
Met
|
1'47
|
0'97
|
0'39
|
|
Glu
|
1'44
|
0'75
|
1'00
|
|
Gln
|
1'27
|
0'80
|
0'97
|
|
His
|
1'22
|
1'08
|
0'69
|
|
Lys
|
1'23
|
0'77
|
0'96
|
|
Val
|
0'91
|
1'49
|
0'47
|
|
Ile
|
0'97
|
1'45
|
0'51
|
|
Phe
|
1'07
|
1'32
|
0'58
|
|
Tyr
|
0'72
|
1'25
|
1'05
|
|
Trp
|
0'99
|
1'14
|
0'75
|
|
Thr
|
0'82
|
1'21
|
1'03
|
|
Gly
|
0'56
|
0'92
|
1'64
|
|
Ser
|
0'82
|
0'95
|
1'33
|
|
Asp
|
1'04
|
0'72
|
1'41
|
|
Asn
|
0'90
|
0'76
|
1'28
|
|
Pro
|
0'52
|
0'64
|
1'91
|
|
Arg
|
0'96
|
0'99
|
0'88
|
Los datos experimentales de la tabla anterior están generados a partir del análisis de la composición de aminoácidos en las secuencias con estructura secundaria en las proteínas. La pregunta que puede formularse a continuación es si dada una determinada secuencia de aminoácidos es posible prever qué tipo de estructura secundaria se formaría. No se puede responder a esta pregunta con una preción mayor de un 60% por numerosas razones entre ellas está la que se extrae directamente de los resultados de la tabla anterior y es que hay aminoácidos que tienen gran tendencia a formar un determinado tipo de estructura pero eso no quiere decir que no puedan formar otra. Por ejemplo, Val forma preferentemente hojas b (1'49) pero también puede formar hélices a en un porcentaje nada despreciable (0'91). Más aún, una misma secuencia puede formar dos tipos de estructura diferente como puede apreciarse en la siguiente figura para la secuencia VNTFV en la ribonucleasa y el la eritrocruorina.
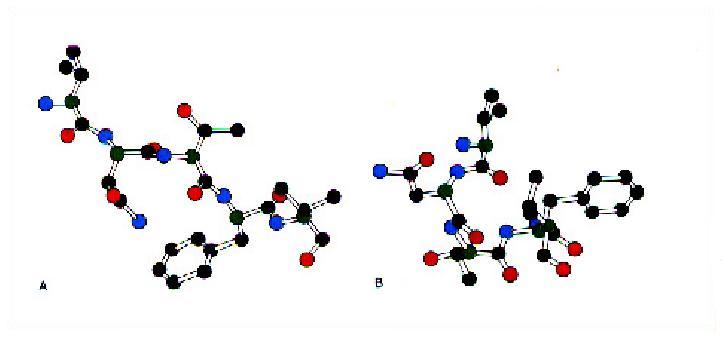 |
Secuencia VNTFV en la ribonucleasa y en la eritrocruorina en conformaciones muy diferentes |
Es evidente, por tanto, que el entorno es esencial en el establecimiento de la estructura secundaria. Las interacciones terciarias (las que aparecen entre resíduos alejados entre sí) son determinantes a la hora de especificar la estructura secundaria de algunos segmentos. No obstante, existen secuencias que sí llevan toda la información necesaria para especificar una estructura secundaria determinada. A estos segmentos se les llama unidades de plegamiento autónomo. Por ejemplo el péptido correspondiente a los resíduos 1-13 de la ribonucleasa A, una región helicoidal en la enzima, presenta en agua a bajas temperaturas un 25% del hélice a o el péptido de 16 resíduos Acetil-AAAAKAAAAKAAAAKA-amino que forma en disolución acuosa un 80% de hélice a.
Ficha
anterior 
|
A
Docencia  |