 |
Biopolímeros (4831) |
 |
|
Módulo 3. Ficha
3.5.4
|
 |
Biopolímeros (4831) |
 |
|
Módulo 3. Ficha
3.5.4
|
PROTEÍNAS
3.5. Estructura de las proteína
3.5.4. Estructura terciaria
La organización tridimensional completa de cada subunidad de una proteína constituye lo que se llama su estructura terciaría. En el modelo interactivo de más abajo se muestra la estructura terciaria de la mioglobina (proteína de transporte de oxígeno) en su forma oxidada.
|
Estructura terciaría de la mioglobina una proteína extraordinariamente compacta (45x35x25 A3) formada en un 70% aproximadamente por a hélices. Situación (en relación a la disposición tridimensional de los elementos de estructura secundaria) del grupo protético hemo (oxidado) formado por un anillo de porfirina que coordina a un átomo de hierro.
|
¿Como se adquiere y se pierde la estructura terciaria? La mayor parte de las proteínas pequeñas se desnaturalizan (es decir, pierden su estructura terciaria y por tanto resultan inútiles para su actividad) de forma reversible al aumentar la temperatura o la acidez del medio o al añadir agentes desnaturalizantes como la urea y el clorhidrato de guanidina. Por ejemplo cuando la ribonucleasa bovina se trata con urea 6M se destruye la estructura terciaria de la proteína y se obtiene el polímero en conformación de ovillo estadístico. Si se trata este polímero desnaturalizado con b-mercaptoetanol (reductor de puentes disulfuro) se obtiene una cadena enzimática totalmente inactiva con las cistinas totalmente reducidas. Si de este sistema se elimina el agente desnaturalizante y se deja que los grupos SH sean lentamente oxidados al aire, la cadena vuelve poco a poco a recobrar sus estructura tridimensional inicial (vease el esquema de la figura siguiente) lo que prueba que la secuencia de aminoácidos en la estructura primaria condiciona totalmente la adquisición de la estructura terciaria. Los experimentos realizados para comprobar la conformación enzimática en función de la cantidad de desnaturalizante confirman que para este tipo de proteínas solo existen dos estados: proteína totalmente extendida (unfolded) o desnaturalizada y proteína totalmente plegada (folded) o nativa de forma que siempre hay un equilibrio entre el estado flegado y el extendido (vease figura inferior).
 |
 |
|
Desnaturalización de la
estructura trimimensional con urea y reducción de puentes disulfuro
con 2-mercaptoetanol
|
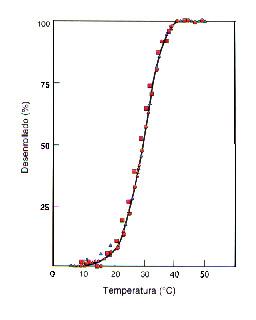
Transición
térmica de la ribonucleasa (cooperativa y reversible). Los
datos experimentales son de viscosidad, actividad óptica y
absorción UV-visible.
|
Existen otro tipo de proteínas en las que en determinadas condiciones de desnaturalización se adquieren configuraciones totalmente diferentes de la plegada o la extendida. Un ejemplo de este comportamiento es la a-lactoalbúmina cuyo espectro de dicroismo circular (esta técnica permite distinguir entre estructuras en hélice a, hoja b y ovillo estadístico) se muestra en la figura siguiente en diferentes condiciones de desnaturalización. A pH 4 la enzima presenta un dicroísmo circular muy parecido al de la enzima nativa, lo que indica que deben tener una estructura secundaria muy parecida. Los estudios hidrodinámicos indican que el intermedio a pH 4 presenta una forma casi tan compacta como la enzima nativa. Por el contrario, la adición de clorhidrato de guanidina (ClHGu) 6M destruye totalmente esta estructura y origina la conformación totalmente extendida en ovillo estadístico. Esto indica que en esta proteína existe un estado intermedio de glóbulo fundido (molten globule) que contiene estructura secundaria nativa pero no estructura terciaria de manera que ahora el equilibrio es entre el estado plegado y el glóbulo fundido y entre este y el estado desplegado.
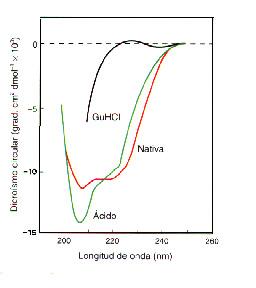 |
Espectros
de dicroismo circular de la a-lactoalbúmina
nativa (rojo), desnaturalizada con ácido (verde) y con clorhidrato
de guanidina (negro)
|
¿Cual es la diferencia entre el disolvente con y sin ClHGu? La diferencia fundamental es la hidrofobicidad del medio. El ClHGu, como el etanol, la urea o el dioxano no tienen la misma capacidad de autoasociación mediante interacción de enlaces de hidrógeno que el agua, es decir la hidrofobicidad del medio es distinta en estos disolventes que en el agua y en consecuencia se modifican, destruyendo en parte, las interacciones hidrófobas generadas en el medio acuoso entre las cadenas apolares. Por tanto las fuerzas que originan la formación de los glóbulos fundidos son de naturaleza hidrófoba. Una cadena polipeptídica en una conformación totalmente extendida en agua es totalmente inestable porque hay muchas cadenas laterales apolares que están en contacto con el agua, lo que no es termodinámicamente favorable. Los grupos hidrófobos se agrupan entonces de manera espontánea mediante interacciones hidrófobas excluyendo el agua. Este agrupamiento se llama colapso hidrófobo.
En la formación del glóbulo fundido también hay que tener en cuenta lo que se dijo anteriormente con respecto a las unidades de plegamiento autónomo en la formación de fragmentos de estructuras secundarias. El interior apolar del glóbulo fundido facilita la formación de hélices al proteger a los grupos NH y CO del enlace peptídico del agua, evitando la formación de los enlaces de hidrógeno con esta y favoreciendo la formación de los puentes de hidrógeno intramoleculares. Por tanto el colapso hidrófobo y la adquisición de estructura secundaria estable son fenómenos que se fortalecen mutuamente cuando se trata de formar glóbulos fundidos.
Ficha
anterior 
|
A
Docencia  |