 |
Biopolímeros (4831) |
 |
|
Módulo 4. Ficha
4.14
|
 |
Biopolímeros (4831) |
 |
|
Módulo 4. Ficha
4.14
|
ENZIMAS
4.5. La inhibición enzimática.
4.5.1. Inhibición competitiva
El inhibidor se une al enzima reversiblemente en el mismo sitio que es substrato y por tanto inhibidor y substrato compiten por el mismo sitio.
La constante KI es la constante de disociación del complejo EI; KI = [E][I]/[EI]. La siguiente expresión da la ecuación de la velocidad de reacción inhibida. En su determinación se ha tenido en cuenta que el enzima puede estar en el medio como enzima libre, como complejo ES o como complejo EI ([E]o = [E] + [ES] + [EI])
![]()
La comparación de la ecuación anterior con la de Michaelis de la reacción no inhibida, indica que la constante catalítica no se ve modificada por la presencia del inhibidor, mientras que la constante de Michaelis del nuevo sistema es mayor que la del sistema no inhibido en un factor (1 + [I]/ KI).
En la figura de la izquierda se representa la doble inversa del sistema no inhibido y del inhibido competitivamente a una concentración dada de inhibidor. Para otra concentración distinta de inhibidor [I]', la pendiente de la representación será mayor si [I]'>[I] y viceversa
4.5.2. Inhibición no competitiva
En la inhibición no competitiva, el inhibidor no se une al mismo sitio que el sustrato.
Un esquema cinético general para este tipo de inhibición no competitiva es:
El caso más simple de este tipo de mecanismos es cuando el inhibidor y el substrato tienen la misma tendencia a unirse al complejo enzima-substrato o al enzima-inhibidor respectivamente, que al enzima libre. Es decir KM = KIM y KI = KSI. Si, además, el complejo ESI es improductuvo (k' = 0), la ecuación de velocidad que se obtiene es:
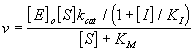
Su comparación con la ecuación de Michaelis del sistema no inhibido indica que, mientras la constante de Michaelis de ambos sistemas no varía, la constante catalítica en el caso de inhibición es más pequeña en un factor (1 + [I]/ KI).
En la figura de la derecha se representa la doble inversa del sistema no inhibido y del inhibido no competitivamente a una concentración dada de inhibidor. Para otra concentración distinta de inhibidor [I]', la pendiente y la ordenada en el origen de la representación serán mayores si [I]'>[I] y viceversa
4.5.3. Inhibición acompetitiva
En la inhibición acopetitiva, el inhibidor no se une en el mismo sitio que el sustrato, pero su unión al enzima aumenta la afinidad del sustrato por el enzima, dificultado su disociación e impidiendo la formación de los productos. En el esquema cinético más sencillo puede suponerse que el inhibidor se une al complejo de Michaelis ES, pero no al enzima y que el complejo ESI es improductivo.
Considérese el caso de dos substratos A y B que compiten por el mismo enzima E, cada uno de ellos con sus propios parámetros de la ecuación de Michaelis. De acuerdo con lo expuesto en secciones anteriores de este capítulo, las velocidades de reacción en uno y otro caso vienen dadas por las siguientes expresiones:
cuyo cociente es igual a
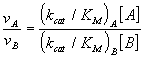
La importante conclusión de la ecuación anterior, es que la especificidad entre dos substratos competitivos viene determinada, no tanto por el valor de sus constantes de disociación KM, sino por la relación de sus kcat/KM
Sean R y P dos compuestos que se encuentran en equilibrio con una determinada constante, Keq, y E un enzima que cataliza una determinada reacción sobre uno de los compuestos, R. Entonces, E también debe catalizar la reacción inversa, ya que el equilibrio sólo se altera mediante el cambio de las funciones termodinámicas. Es decir:
y la relación entre los parámetros de Michaelis de estas reacciones catalizadas viene dada por:
lo cual condiciona los valores de las especificidades del enzima hacia el reactivo y el producto
Ficha
anterior 
|
 Ficha
Siquiente Ficha
Siquiente |