 |
Biopolímeros (4831) |
 |
|
Módulo 4. Ficha
4.15
|
 |
Biopolímeros (4831) |
 |
|
Módulo 4. Ficha
4.15
|
ENZIMAS
4.7. Dependencia del pH
de la catálisis enzimática.
4.7.1 Ionización de ácidos
y bases: ecuaciones básicas.
Sea AH un compuesto con una constante de acidez Ka y sea L una propiedad químico-física cualquiera (absorbancia, conductividad electrolítica, etc.) que dependa de la concentración de sus formas ácida o básica, la forma en que L depende del pH del medio viene dada por la ecuación
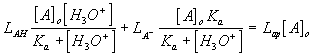
donde LAH y LA- son las constantes de proporcionalidad molares de la magnitud L con la concentración de las especies ácida y básica respectivamente y Lap es el coeficiente de proporcionalidad aparente, es decir, el valor de L dividido por la concentración molar total del compuesto.
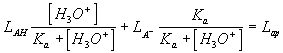
Variación del valor de una magnitud químico-física dependiente de una constante de ionización con el pH del sistema (representación semilogarítmica)
Variación del logaritmo de una constante cinética observada (relativa) con el pH del sistema (representación doblelogarítmica). En el caso representado, la forma ácida del sistema no reacciona
En el caso de sistemas dipróticos, la ecuación anterior se transforma en:
La figura anterior representa el caso de una reacción química que depende de la correcta ionización de dos grupos funcionales, uno es activo en su forma básica (K1) y el otro es activo en su forma ácida (K2). Si en este caso se hubiera utilizado la representación semilogarítmica, se hubiera obtenido una curva con la típica forma de "campana" (bellshape), tan común a muchos procesos catalíticos.
Un punto interesante a tener en cuenta en las ecuaciones anteriores es que, los puntos de inflexión de estas funciones están determinados por el denominador de la función, mientras que el numerador determina la amplitud de la variación de la función. Una reordenación de estas ecuaciones permite la determinación de pKas aparentes, es decir:
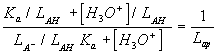
en donde la representación del inverso de la función frente al pH proporciona un pKa aparente: Kap = Ka LA- / LAH
Este es el caso de la mayoría de los enzimas, en donde la actividad es máxima en un rango de pH más o menos estrecho, dependiendo de los grupos esenciales para el proceso catalítico, .
4.7.2 Efecto de la ionización de los grupos en la actividad enzimática
Aunque los enzimas tienen una multitud de grupos que pueden ionizarse en función de la concentración de protones del medio, lo usual es que la actividad enzimática dependa de la ionización de uno o dos grupos que son los realmente importantes, bien porque estén directamente implicados en el mecanismo catalítico, bien porque modifiquen la estructura terciaria global de la proteína, esencial para su correcto funcionamiento.
Un análisis sencillo del efecto del pH sobre los parámetros catalíticos enzimáticos requiere la asunción de una serie de simplificaciones:
- Los grupos ionizables se valoran realmente como á cidos y bases
- Sólo una de las formas ionizadas es la catalíticamente activa
- Los intermedios están en equilibrio protónico (la transferencia de protones es más rápida que los otros pasos químicos)
- El paso determinante de la reacción no cambia con el pH
4.7.2.1 Mecanismo de Michaelis-Menten
En el ejemplo se supone que la forma catalíticamente activa sólo depende de la ionización de un grupo y de que este esté en su forma desprotonada.
Teniendo en cuenta el ciclo termodinámico del esquema de la izquierda puede establecerse la relación entre las constantes de equilibrio termodinámico de cada uno de los pasos: KE K'S = KES KS
Relación de la que pueden extraerse dos importantes conclusiones:
La determinación de la ecuación de velocidad del anterior mecanismo da:
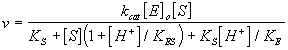
que comparada con la ecuación empírica de Michaelis indica:
Es decir la variación de kcat y KM con el pH (denominador) proporciona el valor del pK del complejo de Michaelis, mientras que la variación de kcat/KM proporciona el valor de la constante de ionización del enzima libre. Lo cual no es mas que la confirmación de una la regla más amplia que dice: "La variación con el pH de la constante de equilibrio o de la constante cinética del proceso X ® Y sigue la ionización de X"
Por tanto en el caso de enzimas libres y de complejos enzimáticos la regla general para la variación de los parámetros experimentales de la ecuación de Michaelis con el pH es:
1.- Dependencia de kcat con el pH.
Proceso: ES ® E + P
Sigue la ionización del complejo ES2.- Dependencia de KM con el pH.
Proceso: ES ® E + S
Sigue la ionización del complejo ES3.- Dependencia de 1/KM con el pH.
Proceso: E + S ® ES
Sigue la ionización del enzima libre y del substrato libre4.- Dependencia de kcat/KM con el pH.
Proceso: E + S ® E + P
Sigue la ionización del enzima libre y del substrato libre
Ficha
anterior 
|
 Ficha
Siquiente Ficha
Siquiente |