Capítulo
0. Introducción/Presentació
 |
Elementos y átomos. Compuestos y molécules. Clasificación de la materia y estados de agregación |
|
Capítulo
1
. Antecedentes de la Mecánica Cuántica y Primeras Teorías atómicas
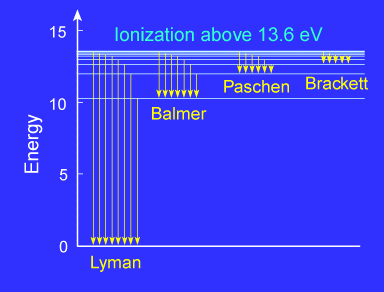 |
Introducción. Partículas elementales. Naturaleza dual onda-corpúsculo de la luz. Radiación del cuerpo negro. Cuantización de la energia. Espectros atómicos. El espectro del átomo de hidrógeno. El modelo atómico de Bohr. |
|
Capítulo
2 Fundamentos de la Mecánica Cuántica
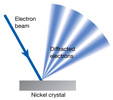 |
Hipótesis de L. de Broglie. Difracción de electrones. La Mecánica Cuántica (MC): Equación de Schrödinger para los estados estacionarios. El principio de indeterminación de Heisemberg. Aplicación de la MC a la resolución de un problema sencillo: la partícula en una caja |
|
Capítulo
3
Átomos Hidrogenoides
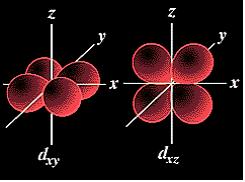 |
La equación de Schrödinger para un átomo hidrogenoide. Concepto de orbital atómico. La energía. Número cuántico n. El moment angular. Número cuántico l. El momento magnético. Número cuántico m. Características de los orbitales hidrogenoides s, p, d. El Espín del l'electrón. Número cuàntico s |
|
Capítulo
4 Átomos Polielectrónicos
 |
El Modelo de la aproximación orbital. Penetración y apantallamiento. Funciones de onda hidrogenoides modificadas. Principio de Construcción (Aufbau, Building up) . Principio de Pauli. Regla de Hund. Configuraciones electrónicas de los estados fundamentales. La tabla periódica de los elementos |
|
Capítulo 5 Propiedades atómicas periódicas
 |
Potenciales de ionización. Tamaño atómico (radio y volumen). Afinidad electrónica. El concepto de electronegatividad de Mulliken. Reactividad química |
|
Capítulo
6
Enlace Químico I
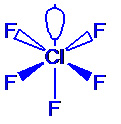 |
El enlace Químico: tipos de enlace químico. Propiedades de los enlaces de las molècules. Teoria de Lewis. Teoria de la Repulsión entre pares de electrones de la capa de valència, RPECV (VSEPR): Moléculas con enlaces sencillos. Moléculas con enlaces múltiples. Geometría y ángulos de enlace. |
|
Capítulo
7
Enlace Químico II
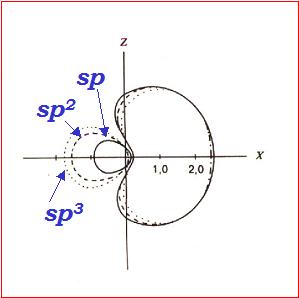 |
Aplicación de la mecànica cuántica a las moléculas. Teoría de Enlaces de València. La molécula de hidrógeno. Solapamiento orbital e intercanvio electrónico. Moléculas poliatómicas. Promoción electrónica e hibridación orbital. |
|
Capítulo
8
Enlace Químico III
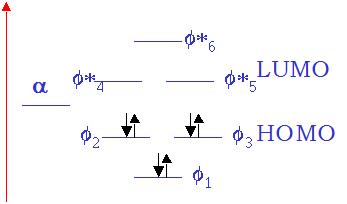 |
Teoría de Orbitales Moleculares (OM). La molécula de ión hidrógeno: Orbital Molecular (CLOA-OM). Estructura de las moléculas diatómicas homonucleares y heteronucleares: Orbitales moleculares s y p. Diagramas de niveles de energía de OM. Moléculas poliatómicas: OM localizados. Conjugación de enllaces p. El enlace metálico. |
|
Capítulo
9
Estados de agregación de la materia
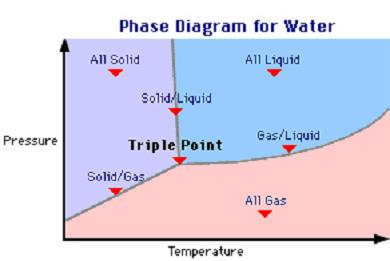 |
Fuerzas intermoleculares: Interacciones electrostáticas. Interacciones de Van der Waals. Enlaces de hidrógeno. El estado gaseoso. El estat sólido. El estao líquido. |
|

![]() Para cualquier sugerencia
sobre la página contactar con josefa
donoso
Para cualquier sugerencia
sobre la página contactar con josefa
donoso![]()









